登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
细胞有几个核???
并非所有细胞都只有1个细胞核喔~
破骨细胞:高度分化的多核细胞,无克隆能力,无法传代培养,且破骨细胞体外培养较为困难......
Section.01 骨代谢: 背景知识
老样子,在开始本期内容前,先来点背景知识做“开胃小菜”! 当然,做骨骼相关研究的小伙伴儿们可自行略过~
首先,我们来了解下有关骨代谢的专业术语! 骨重塑 骨重塑:指的是破骨细胞清除旧骨或受损骨质,并由成骨细胞形成的新骨取代的过程。 骨骼,是一种动态组织。其在人的整个生命过程中是不断被重塑的。持续重塑是维持骨骼关键功能所必需的,它能防止骨损伤的积累,并维持骨骼的机械强度和钙稳态[1]。 骨重塑过程由破骨细胞和成骨细胞的“交流”来调控完成[2]。
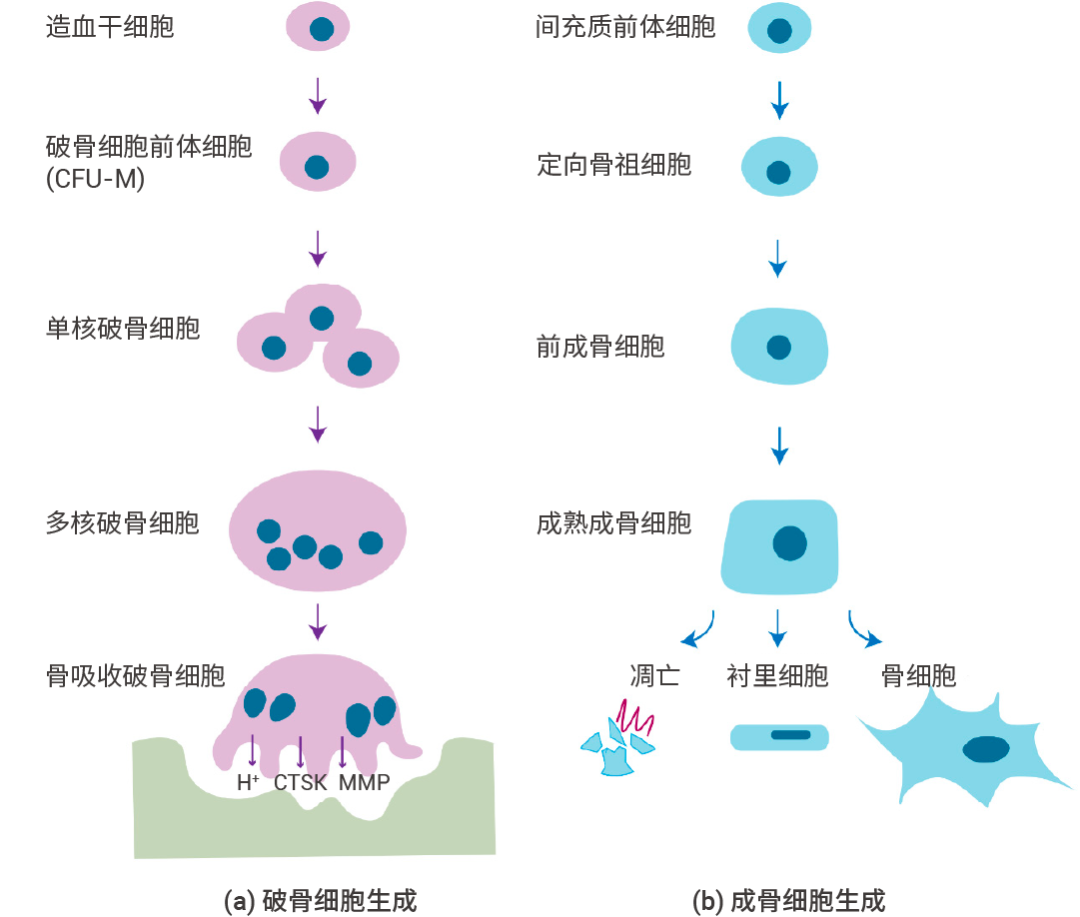 图 1. 破骨细胞生成和成骨细胞生成的策略[1]。 骨矿化 骨矿化:指的就是钙的沉淀过程。钙、磷等无机盐沉淀在骨头组织的过程,就叫骨的矿化。 简单说,矿化是进化过程中的一种被动选择。 生物矿化的起源可以追溯到前寒武纪晚期,当时构造活动导至海水中可溶性矿物显著增加。人们普遍认为,海洋生物首先发展出由碳酸钙和/或磷酸钙矿物组成的原始外骨骼,渐渐地,骨骼组织被内化。矿化骨骼强大的承重能力使得大型脊椎动物得以进化[3]。 作为一种特殊的结缔组织,骨骼具有高度矿化的结构和构造。一方面,作为内部支撑系统,骨骼可为身体提供结构基础,并为运动提供肌肉附着点。同时,骨骼还保护大脑和内脏器官,并为骨髓造血组织提供场所。此外,骨骼也是无机离子 (尤其是磷酸盐和钙) 的主要来源和储存地,它们能够积极参与体内矿物质稳态和能量代谢[4]。 骨吸收 骨吸收:指的是骨钙溶出的过程。也就是把钙从骨头里面“搬”出来。破骨细胞将硬骨组织分解为矿物质,同时将骨骼中的钙释放至血液中。 破骨细胞是唯一明确可降解骨的细胞,在骨稳态和健康维持中至关重要。 破骨细胞是一种组织特异性的多核巨噬细胞,由血液及骨髓中的单核/巨噬细胞系分化而来 (图 2)。其分化过程经历破骨细胞前体 (osteoclast precursor cells,OPCs,或称 preosteoclasts)、融合的多核破骨细胞 (non-functional polykaryons)、成熟破骨细胞 (mature osteoclasts,也称极化的多核破骨细胞) 等几个阶段。
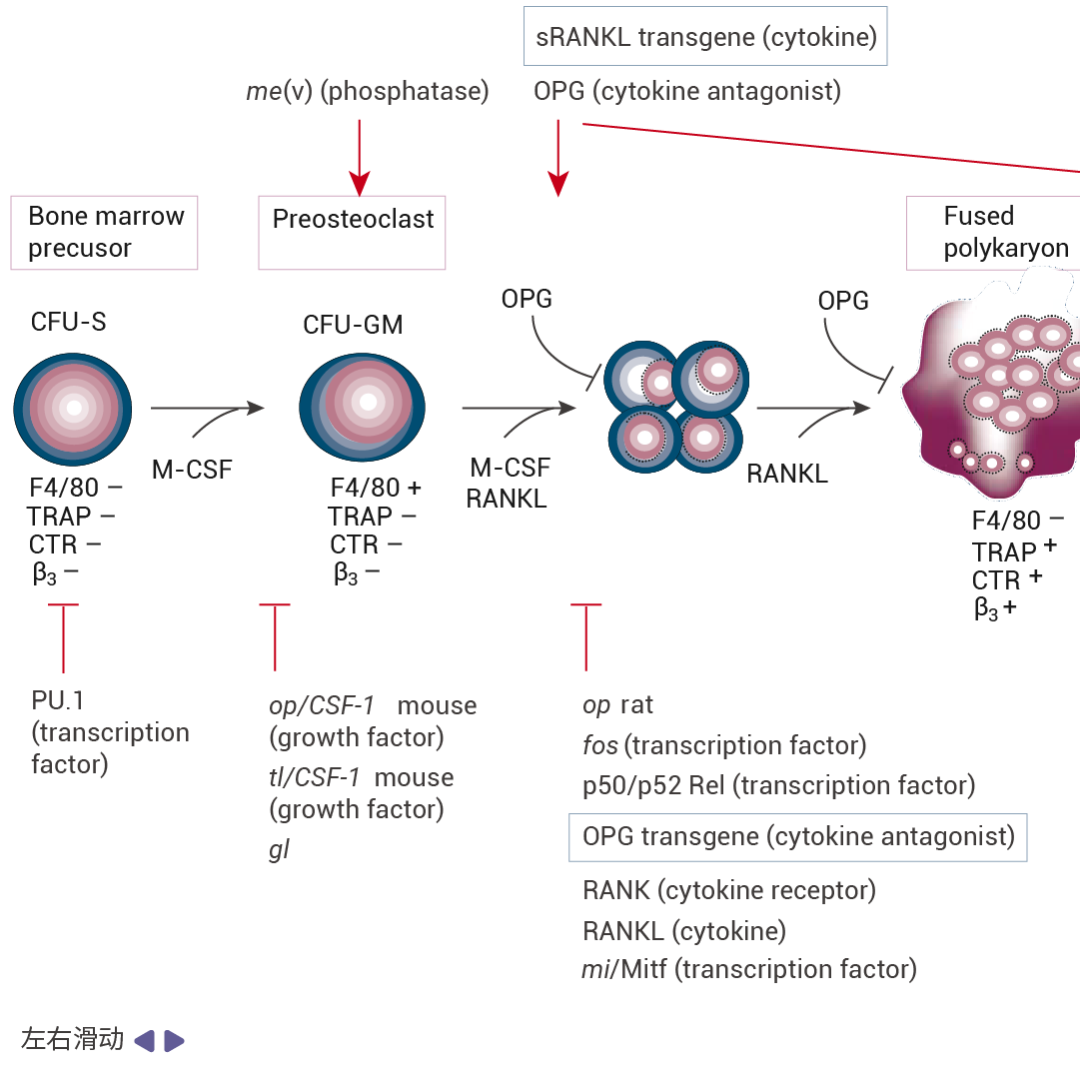 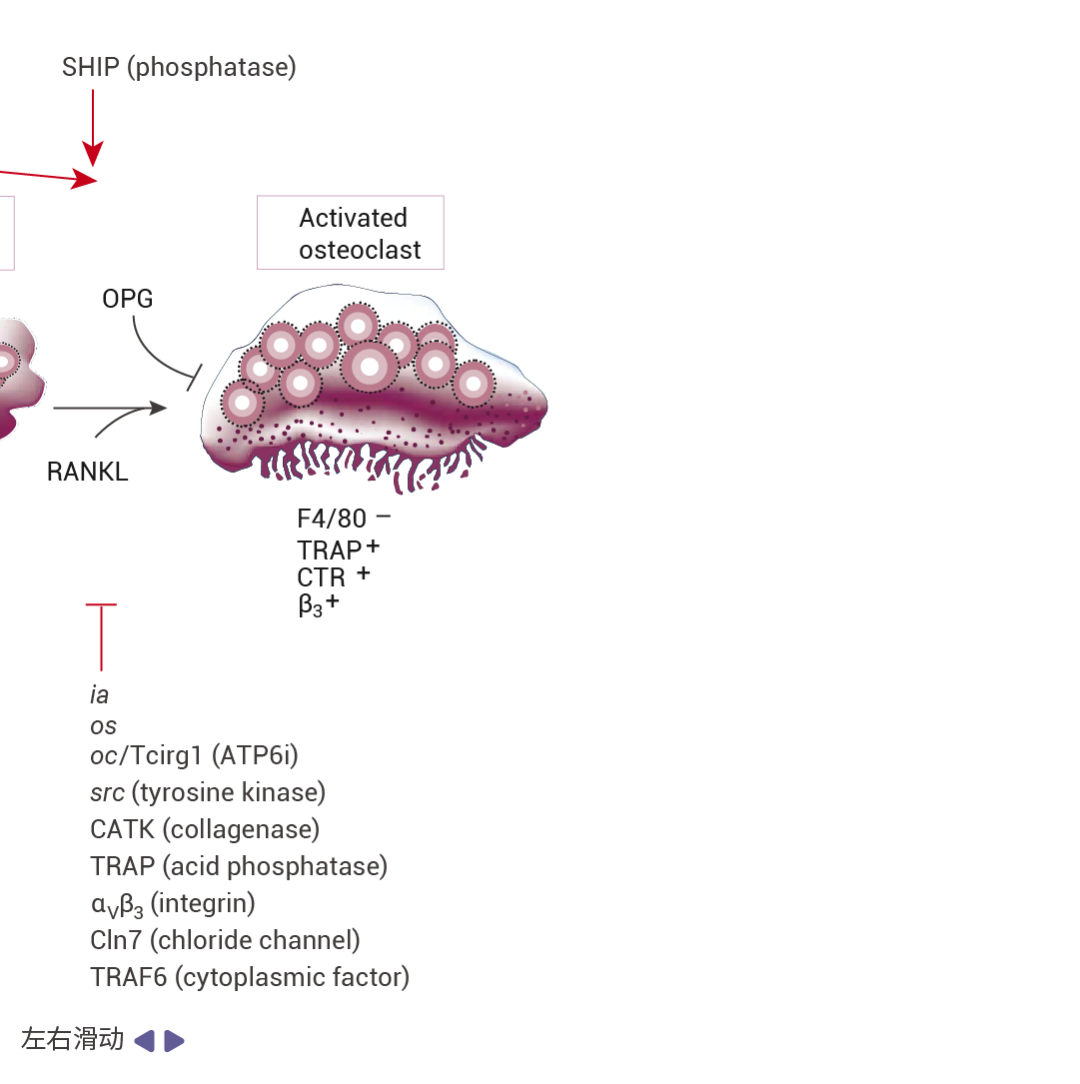 图 2. 破骨细胞分化过程图[5]。 下面显示了阻断破骨细胞生成和活化的单基因突变。斜体字表示在啮齿动物和人类中自然发生的突变,而其他则是通过靶向诱变产生无效等位基因的结果。上面显示的是增加破骨细胞生成和/或活化及存活并导至骨质疏松症的单基因突变等位基因。请注意,除了 OPG22 和 sRANKL77 转基因小鼠过表达模型(蓝色边框)外,所有这些突变均为无效突变。
如图 2 所示,M-CSF(CSF-1)和 RANKL 对破骨细胞生成至关重要,二者缺一不可。OPG 可以结合并中和 RANKL,从而负向调节破骨细胞生成和成熟破骨细胞的活化。
•RANKL:核因子 κB 受体活化因子配体 (Receptor Activator for Nuclear Factor-κBLigand,RANKL) 被认为是促进破骨细胞最为分化成熟及其功能活性最重要的因子,由成骨细胞/间充质干细胞分泌,结合破骨细胞前体膜上的 RANK 受体,激活下游 NF-κB、MAPK、NFATc1 通路。 •M-CSF:巨噬细胞集落刺激因子,可诱导 RANK 在破骨细胞前体的细胞膜上表达,进而使表达 RANK 的破骨前体细胞和 RANKL 结合并产生效应,诱导破骨细胞分化。
目前,已有大量实验证实破骨细胞形成和功能失调与骨质疏松症、骨折愈合、骨关节炎和原发性/转移性骨肿瘤等密切相关[2]。体外诱导破骨细胞分化对研究骨代谢疾病、药物筛选具有重要作用。
Section.02 破骨细胞的体外诱导
目前破骨细胞主要采用的是骨髓单核细胞诱导法 (bone marrow monocytes,BMMs) 和 RAW264.7 细胞系诱导法两种方法。 方案一、小鼠骨髓单核细胞诱导破骨细胞 实验方案 1. 骨髓细胞提取
(1) 取 6-8 周龄小鼠,使用 CO2 吸入致死。用 75% 酒精消毒小鼠毛皮。 (2) 取双侧股骨、胫骨,用无菌注射器吸取无菌 PBS 冲洗骨髓腔 3 次,收集液体于 15 mL 离心管中,300×g 4℃ 离心 5 min,弃上清。 (注:避免用力过猛导至细胞机械损伤) (3) 过 70 -100 μm 细胞筛,1500 rpm 离心 5 min。室温下红细胞裂解液 处理 5 min,PBS 洗涤 2 次。 图 3. 骨髓细胞提取示意图[6]。
2. BMMs 贴壁筛选 (1) 用 5 mL 含 10% FBS 的 α-MEM 培养基重悬,离心,弃上清。 (2) 用 5 mL 含 M-CSF (25 ng/mL) 和 10% FBS 的 α-MEM 培养基重悬细胞。接种于 6 孔细胞培养板中 (每只小鼠一孔),置于 37°C、5% CO2 细胞培养箱中培养过夜。 (3) 收集上清离心,弃上清液 (主要为红细胞和粒细胞),用 5 mL 含有 50 ng/mL M-CSF 的完全培养基重悬后,以 5×104 cells/孔的密度接种于 24 孔板中 (每孔 1 mL),2-3 天后贴壁细胞即为骨髓来源巨噬细胞; 3. 破骨细胞诱导分化 (1) 弃上清液,用无菌 PBS 清洗 2 次。使用含有 50 ng/mL M-CSF 和 50 ng/mL RANKL 的完全培养基进行诱导分化; (2) 细胞每 3 天换一次液,并补加因子 25 ng/mL M-CSF 和 50 ng/mL RANKL,4-6 天后进行诱导鉴定。 不同孔板建议加入的细胞数和培养液体积
MCE 客户验证
图 4.两种多发性骨髓瘤细胞条件培养基 和 M-CSF (HY-P7085, 20 ng/L) 诱导正常小鼠原代巨噬细胞破骨形成[7]。 用 MM 细胞、CM 和 M-CSF (20 ng/L) 处理原代小鼠巨噬细胞,然后进行 TRAP 染色。含有三个以上细胞核且 TRAP 呈阳性的细胞被视为破骨细胞。 方案二、巨噬细胞系 RAW264.7 诱导破骨细胞 实验方案 (1) 用含 10% FBS 的 α-MEM 培养基将 RAW264.7 细胞制成细胞悬液,以 3×104 cells/孔的密度接种于 24 孔板中。 (2) 细胞接种 12 h 后,加入 RANKL (20-100 ng/mL)。每 3 天更换培养基,并同时补加 RANKL (20-100 ng/mL)。 (3) 较为明显的多核破骨细胞将在分化培养 4 天后开始出现,并在第 5 天至第 6 天逐渐变得丰富。 RAW 264.7 细胞表达 M-CSF 及其受体 c-fms。因此,仅加入 RANKL 就足以诱导破骨细胞分化,无需额外加入 M-CSF。
MCE 客户验证
图 5. RANKL (HY-P7425, 35 ng/mL) 诱导 5 天后,Raw 264.7 发生破骨细胞分化[8]。 TRAP 染色视野和定量分析结果显示,与对照组相比,RANKL 处理导至 Raw 264.7 多核破骨细胞数量显著增加 (p < 0.01)。
Section.03 破骨细胞,如何鉴定?
一、形态学鉴定 1. 多核巨细胞 相差显微镜下可见 ≥3 个细胞核 (成熟破骨细胞通常含 10–20 个核)。 2. 伪足结构 活化破骨细胞边缘呈“皱褶缘” (ruffled border),为骨吸收功能区域。鬼笔环肽染色后共聚焦显微镜观察 (特征性"封箱带"结构)
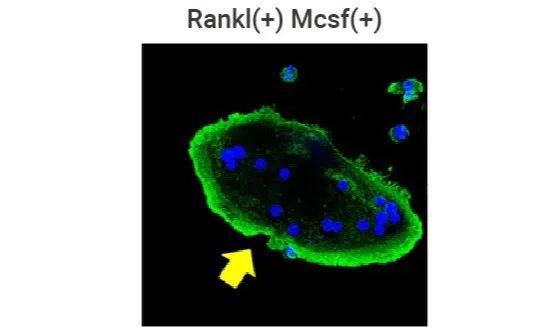 图 6.鬼笔环肽对破骨细胞中的足状体肌动蛋白带进行染色[9]。 M-CSF (30 ng/mL) 和 RANKL (100 ng/mL) 诱导 BMMs 破骨分化。当破骨细胞出现时,用 PBS 轻轻冲洗,用 0.1% Triton X-100 渗透 30 min,最后用罗丹明偶联的 Phalloidin 染色,检测细胞骨架肌动蛋白结构的形成,同时细胞核用 DAPI 复染。
二、功能标志物检测 1. Trap 染色 破骨细胞产生许多酶,其中主要是抗酒石酸酸性磷酸酶 (tartrate-resistant acidic phosphatase, Trap),Trap 特异地分布于破骨细胞中,为破骨细胞所特有,通常作为鉴别破骨细胞的重要标志物。 【实操步骤】 (1) 移除细胞培养液,每孔加入 400 μL PBS 清洗,弃液。 (2) 每孔加入 300 μL 4% 多聚甲醛溶液,室温固定 15-30 min,弃液。 (3) 每孔加入 300 μL PBS,清洗 2 次。 (4) 染色:每孔加入 150-200 μL TRAP 染色液,37℃ 避光孵育 10-15 min (待测样品中酒石酸酸性磷酸酶活性较低时,可适当延长孵育时间至 30 分钟或显微镜下显色至预期深浅)。 (5) 每孔加入 300 μL PBS,清洗 2 次。 (6) 显微镜下观察和拍照。 2. 骨吸收实验 骨髓单核细胞 (BMMs) 接种于羟基磷灰石涂层板或骨片,观察吸收陷窝的情况。 例如,为了检测体外破骨细胞骨吸收功能的影响,将 BMMs 接种于磷酸钙涂层仿骨骨分析 Stripwell 板。培养期间,每天补充一次含有 M-CSF、RANKL 的新鲜培养基。10 天后,用超声波去除骨片表面细胞,用 SEM (扫描电子显微镜) 对吸收凹陷进行成像,并使用 I mageJ 软件对凹陷面积进行量化。用茜素红染色液对磷酸钙涂层仿骨骨分析 Stripwell 板进行染色,并使用共聚焦激光显微镜进行拍照,三维重建,观察骨片中的凹坑[5]。
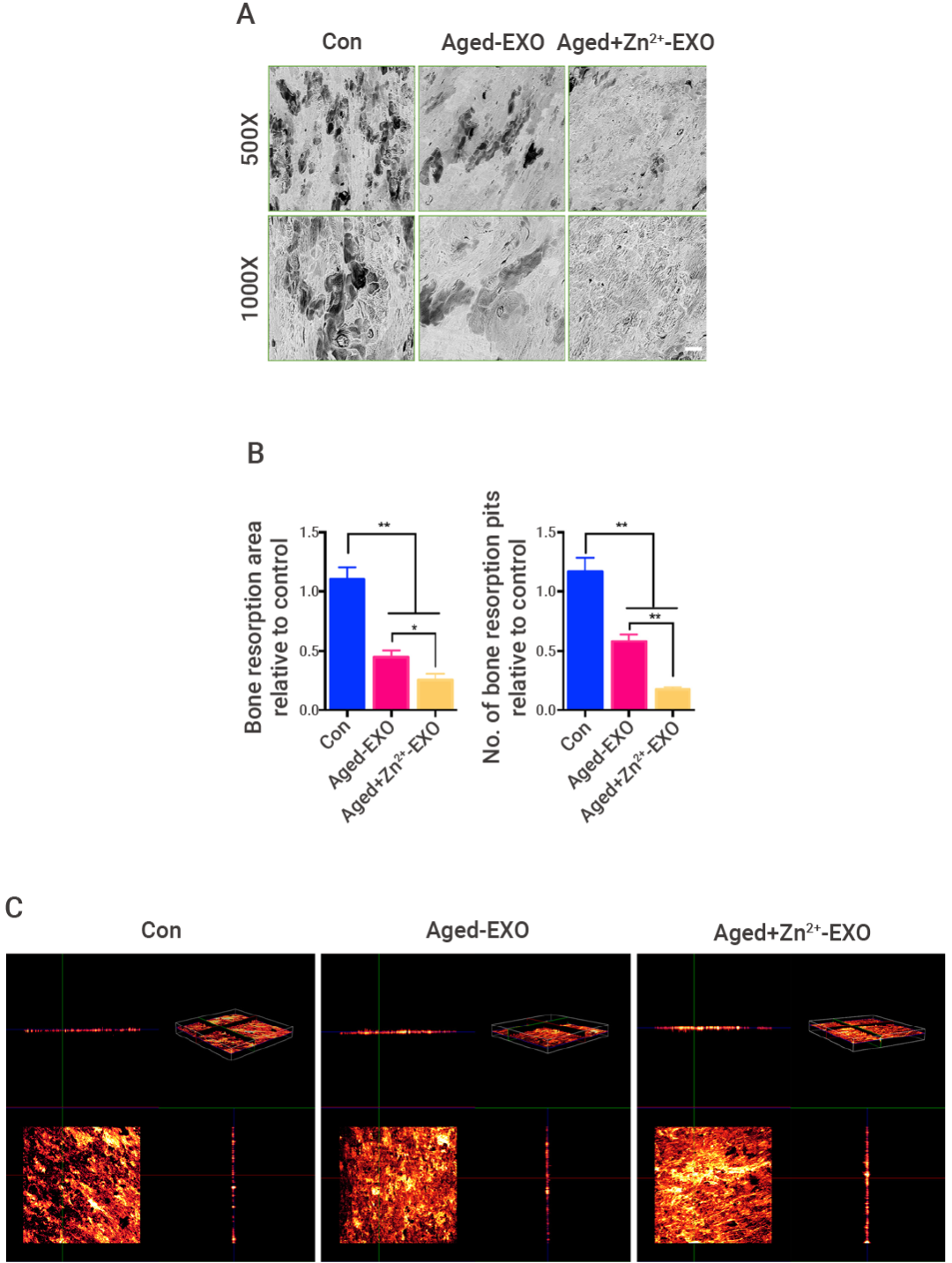 图 7. 高锌环境下的老年骨髓间充质干细胞 (BMSCs) 外泌体能够抑制破骨细胞分化和骨质破坏[9]。 (A-B) 不同同牛骨切片上骨吸收凹坑及其吸收区域的代表性扫描电子显微镜图像和(C)切片上 3D 重建的共聚焦显微镜观察。(Con:正常的 BMMs 破骨诱导组; Aged-EXO:不含锌的老化外泌体处理组; Aged + Zn2+-EXO:添加锌的老化外泌体处理组)
三、分子标志物检测 qPCR/WB 检测 Trap、NFATc1、CTSK (组织蛋白酶 K)、DC-STAMP (细胞融合相关蛋白)。 qPCR/WB 技术实操不在赘述,需要的小伙伴可参考往期推文:从基础到进阶:PCR、qPCR 和 RT-PCR 不是一回事儿?(内含 Protocol);干货分享 | WB 常见问题及解决方案 实验小提示 (1) RAW264.7 细胞在含有 10% FBS 的 RPMI-1640 或 DEME 培养基中可以增殖并保持其分化为破骨细胞的能力,而其在含有 10% FBS 的 α-MEM 中培养可进行破骨细胞分化试验。 (2) RAW264.7 分化为破骨细胞的成功与否与细胞状态密切相关,建议使用 15 代以内的 RAW264.7 细胞。 (3) 分化诱导培养基工作液建议现配现用,使用前注意 37 ℃ 温育。 (4) 使用的 RANKL 和 M-CSF 浓度可能因小鼠和实验室条件而异。 (5) 破骨细胞形成初期,细胞呈纺锤形,成熟后,细胞变大,多核,呈圆形。从 RANKL 和 M-CSF 添加后的第 4 天起,每天至少观察一次细胞,因为小鼠破骨细胞在完全分化后非常不稳定。 (6) 诱导成功后立即进行染色,小鼠破骨细胞在成熟后 24 h 内死亡。 参考文献 [1] Kim JM, et al. Osteoblast-Osteoclast Communication and Bone Homeostasis. Cells. 2020 Sep 10;9(9):2073. [2] DONG Shiwu, et al. Break and then stand: novel insight into osteoclast functions in the skeletal system[J]. Journal of Army Medical University, 2022, 44(1): 79-88. [3] Murshed M. Mechanism of Bone Mineralization. Cold Spring Harb Perspect Med. 2018 Dec 3;8(12):a031229. Erratum in: Cold Spring Harb Perspect Med. 2020 Aug 3;10(8):a040667. [4] Shi C,et al. Recent advances in bone-targeted therapy. Pharmacol Ther. 2020 Mar;207:107473. [5] Boyle WJ, et al. Osteoclast differentiation and activation. Nature. 2003 May 15;423(6937):337-42. [6] Toda G, et al. Preparation and culture of bone marrow-derived macrophages from mice for functional analysis. STAR Protoc. 2020 Dec 31;2(1):100246. [7] Sun W, et al. Sulforaphane inhibits multiple myeloma cell-induced osteoclast differentiation and macrophage proliferation by elevating ferroportin1. Cancer Chemother Pharmacol. 2024 Dec 11;95(1):3.
 
|  /3
/3 